Bu ders notumuzda Kimya dersinin Atom ve Yapısı konusu altında; Atom Nedir? Atomun Yapısı ve Özellikleri, Atom Numarası, İyon, İzotop, Allotrop, Elektronların Dizilişi, Elektronik Konfigürasyon vb. başlıklar hakkında detaylı bilgileri bulabilirsiniz.
ATOM ve YAPISI
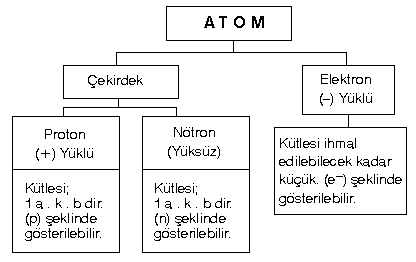
Elementin özelliğini taşıyan en küçük parçasına denir.
Atom Numarası
Bir elementin unda bulunan proton sayısıdır. Protonlar (+) yüklü olduklarından pozitif yük sayısı ya da çekirdek yükü şeklinde ifade edilebilir.
| Atom numarası = Proton sayısı = Çekirdek yükü |
| Kütle Numarası = Proton sayısı + Nötron sayısı |
eşitliği yazılabilir.
Nötr (yüksüz) bir için, çekirdekte kaç proton varsa çekirdeğin etrafındaki yörüngelerde de o kadar elektron dolaşır.
İYON
(+) veya (–) yüklü ya da gruplarına iyon denir.
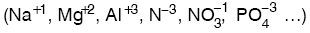
- elektron verirse (+) yüklü iyon oluşur ve katyon olarak isimlendirilir.
- elektron alırsa (–) yüklü iyon oluşur ve anyon olarak isimlendirilir.
Bir X atomu için; 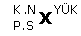 gösterilir.
gösterilir.
Buradan nötron sayısı, elektron sayısı bulunabilir.
İZOTOP
numaraları aynı kütle numaraları farklı olan atomlara izotop atomlar denir.
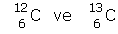 birbirinin izotopudur.
birbirinin izotopudur.
- İzotop atomların kimyasal özellikleri aynıdır. Fiziksel özellikleri farklıdır.
- İzotop iyonların elektron sayıları farklı ise kimyasal özellikleri de farklıdır.
ALLOTROP
Kimyasal özellikleri aynı (aynı dan oluşmuş), fiziksel özellikleri (renk, kaynama noktası, erime noktası, uzaydaki dizilişleri v.s.) farklı olan maddelere allotrop maddeler denir.
Elmas, grafit, amorf karbon, üç madde de yapısında yalnızca karbon (C) u içerir. Fakat uzaydaki dizilişleri ve bağların sağlamlığı farklı olan maddelerdir.
O2 gazı ve O3 (Ozon) gazı birbirlerinin allotropudur. Allotrop için bilinmesi gereken en önemli özellik ise;
Allotrop maddeler bir başka madde ile reaksiyona girdiklerinde aynı cins ürünler oluşur.
2Ca + O2 ® 2CaO
3Ca + 2/3 O3 ® 2CaO gibi.
Modern Teorisi
- Elektron dalga özelliği göstermektedir.
- Atomdaki elektronun aynı anda yeri ve hızı bilinemez.
- Elektronların bulunma ihtimalinin fazla olduğu küre katmanları vardır ve bu katmanlara orbital denir.
ELEKTRONLARIN DİZİLİŞİ
Pauli Prensibi
- Elektronlar yörüngelere yerleştirilirken ;
- 2n2 formülüne uyarlar.
(n : yörünge sayısı, 1,2,3 ………. gibi tamsayılar) - Son yörüngede maksimum 8 elektron bulunur.
Buna göre, her yörüngedeki elektron sayısı :
1. yörünge : 2.12 = 2 elektron
2. yörünge : 2.22 = 8 elektron
3. yörünge : 2.32 = 18 elektron
4. yörünge : 2.42 = 32 elektron alır.
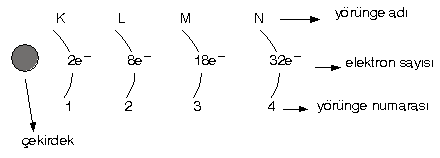
Elektronik Konfigürasyon
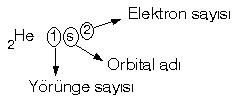
Bir atomun elektronlarının hangi yörüngede olduğu ve orbitallerinin cinsinin belirtildiği yazma düzenine Elektronik konfigürasyon denir.
n : Baş kuant sayısı olup 1, 2, 3, … gibi tam sayılardır. Elektronun hangi yörüngede olduğunu belirtir.
l : Yan kuant sayısı olup, orbital adı olarak bilinir, s, p, d, f gibi harflerle anılır.
Elektronlar önce düşük potansiyel enerjili orbitallere yerleşirler. Dört değişik enerji düzeyi vardır.
s : Enerji seviyesi en düşük orbitaldir. 2 elektron alabilir.
p : s orbitalinden sonra elektronlar p orbitallerine yerleşir. px , py , pz olmak üzere 3 tanedir. p orbitalleri toplam 6 elektron alabilir.
d : 10 elektron alır ve toplam 5 tanedir. p orbitallerinden sonra elektronlar d orbitallerine yerleşirler.
f : f orbitalleri toplam 14 elektron alır ve 7 tanedir. Enerji düzeyi en yüksek olan orbitaldır.
| Yörünge Sayısı (n) | Yörüngedeki orbital sayısı(n2) | Yörüngedeki elektron sayısı (2n2) |
| 1………. | 1 (1 tane s) | 2 |
| 2. ……… | 4 (1 tane s, 3 tane p) | 8 |
| 3. ……… | 9 (1 tane s, 3 tane p, 5 tane d) | 18 |
| 4. ……… | 16 (1 tane s,3 tane p, 5 tane d, 7 tane f) |
32 |
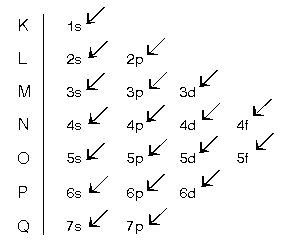
Bir atomun elektronları yörüngelere yerleştirilirken okların sırası takip edilir. Bunlar bu sıra ile yazılırsa aşağıdaki gibi olur.
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6
Periyot : Dizilişi yapılan elementin en son yazılan s orbitalinin başındaki sayıya periyot denir.
Grup : Son yörünge orbitalleri s ve p ile bitiyorsa A grubu, d ve f ile bitiyorsa B grubu elementidir.
- A grupları son yörüngelerindeki s ve p orbitallerindeki elektronların toplamıyla bulunur.
X: 1s2 2s2 2p6 3s2 3p6 dizilişine göre atom 3. periyot, 8A grubundandır.
|
Idare eder
BAYA İYİ TEŞEKKÜRLER…
bence sınavlara hazırlı için çok iyi
ehhh işte iyiymiş ,ama daha düzenli ve sayfalar halinde olsa daha iyi olurdu.
çok güzel bir site bunları hazırlayanların ellerine sağlık
özge geç oldu biraz ama winRAR arşiv yoneticisi var yardımdı olur mu bilmiyorum.
indiriyorum ama acılmıyo
Derscalisiyorum.com Yöneticisi Cevap:
Merhabalar. Bilgisayarınız da .rar dosyasını açmanıza yardımcı olacak program var mı?